IVDR-konforme Geräte- und Analysesoftware
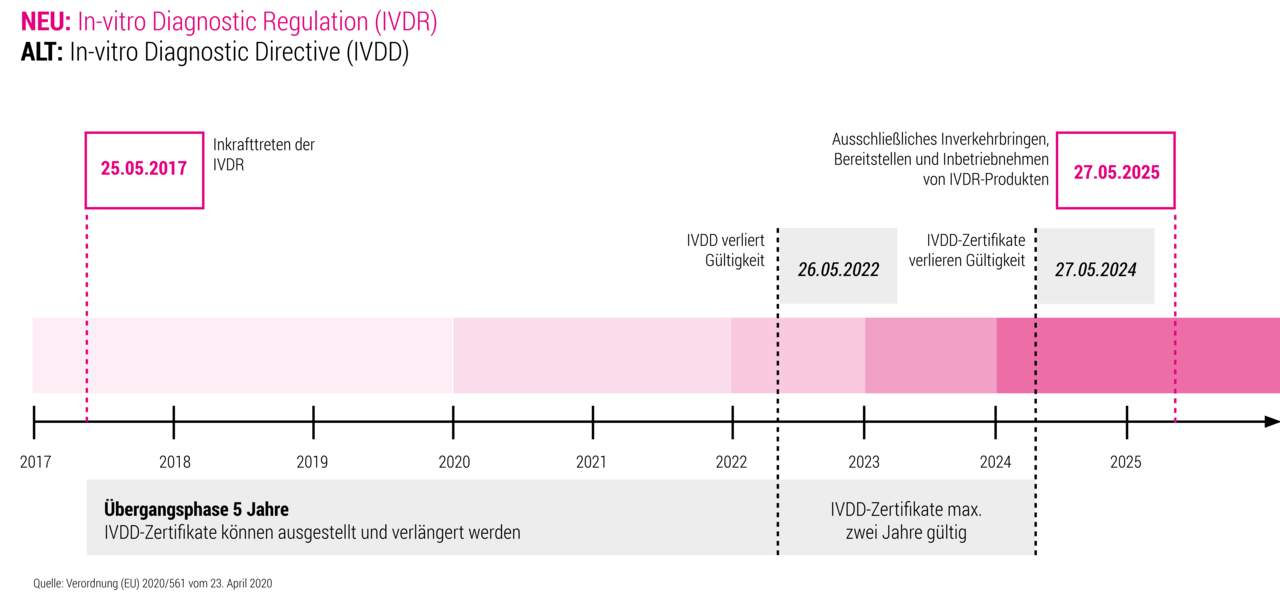
Ab 26. Mai 2022 gilt die Verordnung (EU) 2017/746 des Europäischen Parlaments und des Rates über In-vitro Diagnostika. Anbieter medizinischer Geräte und Analysesoftware sind bei Inverkehrbringung von Produkten zur Einhaltung der Verordnung verpflichtet. Unsere Expertise in IVDR-konformer Entwicklung von Geräte- und Analysesoftware beinhaltet die Anwendung aller geltenden Normen, wie beispielsweiße IEC 62304-Softwarelebenszyklus, ISO 14971-Risikomanagement und IEC 62366-Gebrauchstauglichkeit. So ermöglichen wir unseren Kunden einen schnellen, kostengünstigen und regelkonformen Marktzugang.
Schritt für Schritt zur IVDR-konformen Lösung
Unsere Fachkompetenz liegt in unserem eingespielten Expertenteam aus Spezialisten der Bereiche IT, Biologie, Mathematik, Forensik, Physik und Lieferkettenmanagement.
Ganz gleich welche Lösung Sie benötigen, wir bringen Sie zum Ziel. Wir betreuen Sie in allen Herstellungsschritten, von der Beratung bis hin zur Validierung. Sowohl die Software-Neuentwicklung, als auch die Anpassung Ihrer bestehenden Software ist Teil unserer Leistung.
Wir nehmen alle Hürden
- IEC 62304 Medizingeräte-Software – Software-Lebenszyklus-Prozesse
- IEC 62366 Gebrauchstauglichkeit Medizinprodukte
- ISO 14971 Risikomanagement Medizinprodukte
Für IT-Security auf dem aktuellen Stand der Technik.
Wir helfen Ihnen bei der Umsetzung Ihrer Projekte, damit Sie den gesetzlichen Ansprüchen zur Produktsicherheit entsprechen.